mRNA的出核之旅:一段曲折历程 |
您所在的位置:网站首页 › calendaring machine cell › mRNA的出核之旅:一段曲折历程 |
mRNA的出核之旅:一段曲折历程
|
封面图源:Williams et al., 2018 导引 经历过高中生物的读者至少已经学到过这样一个流程:细胞通过RNA聚合酶,以DNA为模板合成mRNA——mRNA被核糖体“扫描”,然后根据它的碱基顺序,按照一一对应的密码本,翻译成多肽上的氨基酸序列,这是我们所熟悉的「中心法则」的最简单的执行过程。很快,在生物化学或者分子生物学之类的本科课程中,可以了解到mRNA一般都并非DNA序列原原本本的抄板。它们会事先在细胞核内经过剪接体(spliceosome)的处理。剪接体会将最初转录得到的RNA中间的某些片段——我们称作“内含子”——“剪”掉,然后把剩下的部分(称为“外显子”)拼起来,这才成为了一个成熟的mRNA。先前那个不成熟的,没有剪接过的,被称为前体mRNA(pre-mRNA)或者“核不均一RNA”(heterogenous nuclear RNA, hnRNA)。95%的基因,都是这样的“断裂基因”——被内含子序列分成很多零碎片段,必须经过剪接将零落的外显子重新拼起来,才能合成正常的蛋白质的基因。但表观遗传学开始告诉你,剪接体并没有那么死板,它完全有可能漏剪几个内含子,或者“不小心”把外显子剪掉,这就是可变剪接。这个时候,你是不是要开始叹息:小小的细胞/为何总是欺骗我~~?围绕究竟怎么错剪,怎么漏剪或者多剪,可以衍生出将近十来种可变剪接机制,可变剪接产生不同的mRNA,可以翻译出功能不同甚至截然相反的蛋白质。剪接体是由上百个蛋白质和5个RNA构成的巨型机器装置(若不是它位于细胞核内,它早已有资格称之为细胞器了),今天的分子生物学在了解剪接体组成与作用方式的道路上行走得如鱼得水。 然而,读者果真认为一条成熟的mRNA从转录到翻译所经过的历程都是相互孤立的,就像流水线一样批量式的吗?又一次颠覆认知的时候到了。这里就要说到mRNA的生涯中一个经常被我们所忽略,但是它的方式和机制却异常复杂的过程——出核转运。 mRNA可以包含异常巨量——例如可能是几万个——的碱基,这必将使它成为一个巨型分子,所以永远不要想象mRNA能直接穿过严丝合缝的双层核膜。难道是细胞变了一个魔法把mRNA“变”出去了吗?难道是mRNA量子隧穿直接“飞”出了细胞核?显然不是。 熟悉核孔的读者会知道核孔是怎么样工作的,但这个问题可能也能将他们难倒。让我们来简单介绍一下核孔(复合体)。在20世纪中半时,研究人员第一次观察到核孔。示意图给你的感觉可能是它长得像个篮球框: 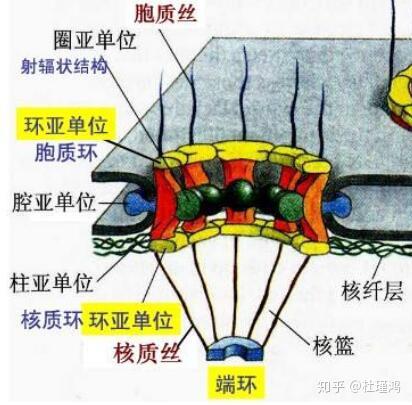 核孔结构示意图。图源:网络 核孔结构示意图。图源:网络核孔复合体的胞质环:  核孔胞质环的结构。图源:Huang et al., 2020 核孔胞质环的结构。图源:Huang et al., 2020后来的工作发现(从上图也应能直观感受到),核孔并非大家最初想象的那样是某种粗犷的光溜溜的圆洞(此处无意开车),而是由几十种有着明确分工配合的蛋白质——被称为核孔蛋白(nucleoporin, Nup)——组成,能够“审核”并“允准”那些具有出入细胞核的资格大分子物质的“门禁”通道。核孔会扫描蛋白质上的某段特殊的被当作“令牌”的氨基酸序列,这样它才能够通过核孔,如果没有令牌,或者令牌的氨基酸顺序不对,将被拒之门外。对于细胞核内要离开细胞核的蛋白质,与细胞核外要进入细胞核的蛋白质来说,它们的“令牌”的氨基酸顺序还是不一样的。我们分别赋予这些“令牌”两个特殊的名字——核输出序列(nuclear exporting sequence, NES)与核定位序列(nuclear localization sequence, NLS),“S”也可以表示信号(signal),这就像是输入密码一样,只有发送正确的信号才能离开或者进入细胞核。 mRNA的尺寸这么庞大,而它是RNA而非蛋白质,也并没有氨基酸序列,它是怎么离开细胞核的呢?答案是有蛋白质将mRNA经过核孔运了出去。 什么样蛋白质呢?这就是一个有趣的问题。 谁是转接因子 90年代,一些关于这个问题的答案开始浮现在显微镜下和跑胶图中。研究人员鉴定出了一系列以前从未发现过的蛋白质,例如THO1、THO2、Mex67、CRM1等等。Mex67和CRM1都是“运输车”,是主要负责运送“货物”的蛋白。CRM1——全称是染色体区域维持蛋白1(chromosomal region maintenance 1)——又叫外输蛋白1(exportin 1, XPO1),这个名字足以提示你它的功能:它是核孔的“门卫”(尽管并非核孔的组成部分),能够“审查”核输出信号并能够开放核孔。它负责运送各种杂类的RNA——例如miRNA、LncRNA、rRNA等出细胞核,这需要一些被称作转接因子(adaptor)的蛋白借助RanGTP将CRM1与RNA连接起来。miRNA也可能依靠外输蛋白5(XPO5)出核。 但是CRM1是负责将mRNA送出细胞核的蛋白质吗? 情况可能更复杂一些。研究者认为,一部分mRNA确实是由CRM1输送的。但一个名叫NXF1的蛋白才是mRNA最主要的“运输车”,而将NXF1与mRNA连接起来的转接因子主要是TREX,这是一个多蛋白复合物——跟霸王龙的学名有点像,但跟霸王龙没啥关系。“TREX”是“转录-输出”(Transcription-Export)的缩写。它是由THO复合体(其组成部分包括Thoc1、Thoc2、Thoc5、Thoc6和Thoc7)、Aly、UAP56、Tex1、CIP29、Chtop等组成的。 (这些蛋白质的全称: (THO是指“suppressors of the transcriptional defects of hpr1Δ by overexpression”(hpr1Δ转录缺陷过表达抑制物)。坑爹的是,当年何塞·皮鲁阿特(José I. Piruat)与安德烈·阿奎莱拉(Andrés Aguilera)在酵母细胞中发现Tho1(Thoc1)和Tho2(Thoc2)时,没有在论文中明确说明他们将这个复合物命名为“THO”的理由,只是在三个首字母上打了下划线,导致很多数据库网站将其全称尴尬地称作“转录延长复合体THO”(无力吐槽)。  Piruat JI, Aguilera A. A novel yeast gene, THO2, is involved in RNA pol II transcription and provides new evidence for transcriptional elongation-associated recombination. EMBO J. 1998 Aug 17;17(16):4859-72. doi: 10.1093/emboj/17.16.4859. PMID: 9707445; PMCID: PMC1170815. Piruat JI, Aguilera A. A novel yeast gene, THO2, is involved in RNA pol II transcription and provides new evidence for transcriptional elongation-associated recombination. EMBO J. 1998 Aug 17;17(16):4859-72. doi: 10.1093/emboj/17.16.4859. PMID: 9707445; PMCID: PMC1170815.(Aly是“Ally of AML-1 and LEF-1”的简写。Aly蛋白也称为Tho4(Thoc4)或者酵母RNA退火蛋白(Yeast RNA Annealing protein 1, Yra1); (UAP56指的是“56-kDa U2AF-associated protein”,即“分子量为56kDa的U2AF相关蛋白”。U2AF是U2 snRNP auxiliary factor即U2 snRNP辅助因子。这个蛋白质又叫人类淋巴细胞抗原B相关转录本1蛋白(HLA-B-associated transcript 1 protein, BAT1),这个蛋白有RNA解旋酶活性; (CIP29即“cytokine-inducible protein 29 kDa”,也就是一个“分子量为29kDa的细胞因子诱导的蛋白”; (Tex1的“Tex”相当于是把“TREX”中的“R”去掉了。它也正是Tho3(Thoc3); (Chtop的全称是“Chromatin target of PRMT1 protein”,也就是蛋白质精氨酸N-甲基转移酶1(PRMT1)的染色质靶点。) 总之,TREX也就是10来个蛋白质组成,作为一个整体发挥作用的复合物。为什么还要在TREX下面再划分一个“THO”?这便不得不谈及TREX是怎么发挥作用的。THO复合体在转录还没结束(可能在转录刚开始)的时候就已经出现在RNA上了。随着转录的进行,Aly、UAP56也逐渐与RNA和转录机器靠近并结合过来。它们对转录的不断持续可能至关重要,少了它们,RNA可能还没转录完就会从DNA上掉下来——没错,这些蛋白质还有其他功能,所以别被本文的主题所误导了。 后续,mRNA在剪接的时候,剪接体会负责将各个TREX的组成部分拼在一起,组成完整的TREX,这个过程会消耗ATP,结合在RNA的5’端——尽管那个时候它的这一段被加上了一个“帽子”,一个7-甲基鸟苷酸三磷酸,真正的5’端并不存在。不过,一些研究者指出,拼装TREX复合物的过程可能并不是剪接体在专门操作,尽管大部分操作是剪接体进行的。 剪接体是如何拼装TREX复合体的呢?这个过程的大部分细节都是未知数,要等待读者去揭开了。对于人类来说,有的研究认为TREX可能是直接作为一个整体直接被牵过来然后与RNA的5’端(即转录开始的那一端,也就是被加上帽子的那一端)结合的。 这里要顺带一提的是,哪怕是在剪接完成之后,mRNA也不会就变此变成光溜溜的RNA,上面仍旧结合着大坨蛋白质。例如,每两个外显子之间的接合处的上游20个碱基的位置都会有一个外显子连接复合体(exon junction complex, EJC)。  EJC。图源:Bono et al., 2006 EJC。图源:Bono et al., 2006当你看到“复合体”的时候,就能想象到,又是一大坨好几个蛋白——主要包括MAGOH(MAGO NASHI)、RBM8A(RNA-binding motif 8A或Y14)、MLN51(metastatic lymph node 51),以及真核生物翻译起始因子4A3(eIF4AIII)。Aly似乎也被算作是EJC的组成部分——这就好像有人也把它和Tex视为Tho复合体的一部分那样,总之,EJC的功能也并非是如它的名字所彰示的那样——只有连接一个个外显子那么简单。事实上,EJC会被一同带出细胞核,如果翻译机器发现mRNA有异常,比如终止密码子出现得太早了(称为提前终止密码子(premature translation termination codon, PTC))——那么RBM8A将会引发无义介导的mRNA降解(nonsense-mediated mRNA decay, NMD,让人魔怔的名字)机制。EJC在细胞核内时,会结合UPF2(Up-frameshift suppressor 2),出核孔之后又通过RBM8A招募UPF3。如果NMD机制最终被触发的话,这两种蛋白是用来共同促进与核糖体结合的UPF1发挥它水解ATP和RNA解旋酶活性,由此引发接下来的NMD机制的。有意思的是,NMD并不是把含有PTC的mRNA截断的唯一方式,mRNA的终止密码子出现得过早同样会阻碍mRNA出细胞核。天知道这种神奇的操作是怎么做到的!如果让这类mRNA拿去翻译而产生被截短的肽链,随后合成的蛋白质将对细胞产生毒性,细胞大概就是在这样的权衡下进化出这种审查机制的吧。 剪接体只是TREX的一个主要组装机制。那么有什么其他因素在影响TREX的形成吗? 帽子就也参与了TREX的形成和功能的正常发挥。首先,没有帽子的mRNA必不可能出核。其次,与帽子结合的蛋白质参与TREX的组装。它们就是正宗的“帽子结合蛋白”(cap-binding protein, CBP),或者“帽子结合复合体”(CBC),包含NCBP1(也叫CBP80)、NCBP2(也叫CBP20)或NCBP3(NCBP:nuclear cap-binding protein)中的一个,与亚砷酸盐抗性蛋白2(Arsenite-resistance protein 2, Ars2)。CBP80能与Aly和THO结合,而UAP56能结合Aly与CIP29;Ars2与TREX也存在某种神秘的相互作用,并且会影响TREX的运输作用。未来,帽子和它的结合蛋白会被带出细胞核。除非翻译起始因子能够识别帽子和帽子结合蛋白,否则mRNA将不会翻译,并且随后被降解掉。  帽子结合复合体(包含CBP80和CBP20)。PDB号:1N52 帽子结合复合体(包含CBP80和CBP20)。PDB号:1N52不过,帽子与其他蛋白质的相互作用并非只有TREX这个个案。mRNA还处在细胞核内部的时候,CBC还与核外泌体靶向(nuclear exosome target, NEXT)复合体和外泌体复合物存在相互作用,而它们都是细胞内训练有素的降解异常RNA——例如启动子上游反义转录本(promotor-upstream transcript, PROMPT)、内含子的RNA、长散在重复序列(LINE)RNA等——的机器。这点暗示着什么呢? 尾巴也不例外。不过,这里需要解释一下尾巴是怎么形成的:当转录即将结束时,多聚腺苷酸化特异因子(Cleavage and polyadenylation specificity factor, CPSF)及切割活化因子(Cleavage stimulation factor, CstF)两个蛋白质复合物会同RNA聚合酶II结合。mRNA尾部有一个多聚腺苷酸化信号(polyadenylation signal, PAS),碱基排列是AAUAAA。CPSF结合PAS序列,CstF与其后的富含G/U的序列结合;切割位置大约位于PAS序列后方35个核苷酸。多聚腺苷酸聚合酶(PAP)随后合成多聚腺苷酸,这样尾巴就形成了。随后,多聚腺苷酸结合蛋白2(Polyadenylate-binding protein 2, PAB2或者PABPN1)等蛋白质与尾巴结合。 实验研究的结果显示,PAB2和一个CstF的组成部分——CstF2,对mRNA的核外输都非常重要。没有尾巴和尾巴太长的mRNA也都不能正常出核,从而导致滞留在细胞核内部。Aly结合到mRNA的尾部的过程是需要PAB2和CstF2来参与的。Aly也能与剪切复合物的成分之一Pcf11结合,Pcf11因而具有招募Aly的能力。但Aly与Pcf11的结合是同时与另一个多聚腺苷酸化因子Clp1相互竞争的,所以Aly与Pcf11的结合会抑制RNA的3’端处理。一个名叫CFIm68的3’端加工蛋白更是能与NXF1直接相互作用。不过,以上这些机制似乎难以解释为何尾巴的长度会影响出核——NXF1也能反过来影响尾巴的长度,实验发现NXF1突变体的转录终止和尾巴加工都出现异常,看起来NXF1扮演的角色似乎不止是简单地作为一个“运输车”。让我们期待某个佚名或者「已注销」同志来告诉我们答案吧。 不仅是尾巴的长度,整条RNA的长度都对通过什么方式出细胞核有影响。当我们利用生物技术在本来由磷酸化转接因子RNA外输蛋白(phosphorylated adaptor RNA export protein, PHAX)通过招募CRM1-RanGTP来运输的某些小核RNA(snRNA)中插入一些额外的片段,比如一个内含子,或者一段多聚腺苷酸尾巴时——这一行为导致snRNA使用TREX复合体作为它的转接因子,借助NXF1来出细胞核;本来应该由TREX送出细胞核的mRNA在被人为删除大段片段导致只剩下一百多个碱基时,又开始选择PHAX-CRM1的方式出核了。但真正的“长”与“短”的界限似乎并不那么清晰,PHAX和Aly更有可能是在“争抢”RNA,就好像谁运的“货”多就要受到更多奖赏一样。 TREX形成后,通过Thoc5和Aly招募核RNA输出因子1(Nuclear RNA export factor 1, NXF1)与p15的异源二聚体,NXF1,将这两个蛋白质锚定在mRNA上。 NXF1就是前面提到的Mex67,但恕我在这里才加以介绍。Mex67是它在酵母细胞中被发现时冠以的名字。(我还把这个当作QQ加我好友的审核问题。虽然难趴了很多同学,不过这并不是加我好友的必要条件,我还是很欢迎跟广大知友朋友的~)它包含一个RNA结合结构域,4个富含亮氨酸的重复氨基酸序列,一个核转位因子2(nuclear transport factor 2, NTF2)样结构域NTF2LD,以及一个泛素相关结构域。  NXF1与RNA结合。PDB号:3RW6 NXF1与RNA结合。PDB号:3RW6NTF2LD使之能够与NTF2相关外输蛋白1(NTF2-related exporting protein, NXT-1),也就是p15,形成异二聚体;泛素相关结构域则能与核孔复合体相互作用。借助NXF1-p15,mRNA便被送出了细胞核。 在mRNA被运出细胞核以后,五磷酸肌醇2-激酶(Ipk1)催化肌醇-1,3,4,5,6-五磷酸(Inositol-1,3,4,5,6-pentakisphosphate, Ins(1,3,4,5,6)P5, InsP5)接受ATP的一个磷酸基,转化为肌醇六磷酸(InsP6)。InsP6与核孔蛋白Gle1——虽然可以在核质之间穿梭,但平时依托两种核孔蛋白Nup155和Nup42被固定在核孔朝向的胞质一面——结合,共同激活之前与RNA结合的死亡盒子蛋白Dbp5(DEAD box protein)的RNA解旋酶活性,从而将NXF1-p15从mRNA上卸下。这样似乎是防止了mRNA不小心被再次运回核内。 真是一个聪明的细胞! “不那么经典”的出核路径 TREX-2是一种发现得更晚的mRNA转接因子。它的组成包括: 生发中心相关核蛋白(germinal-center associated nuclear protein, GANP)、PCID2(PCI domain containing protein 2)、DSS1(Deleted in split hand/split foot protein 1)、ENY2(Enhancer of yellow 2 transcription factor)(这些名字取得太坑爹了,恕笔者懒得翻译,大家看看就好)和中心体蛋白2或3(centrin(CETN) 2/3)等等。 看这些名字就知道,TREX-2的组成部分各个都是百般绝活:ENY2和GANP能与RNA聚合酶II发生作用,从而促进某些基因的转录;在酵母细胞中,TREX-2还能与介导子(Mediator)复合体相互作用,TREX-2的组分之一Sus1甚至就是转录共激活复合物(更常用的名字是Spt–Ada–Gcn5–acetyltransferase,所以缩写是SAGA)的组成部分。这个复合物能协助招募通用转录因子,Sus1在其中主要负责组蛋白H2B的去泛素化。还有中心体蛋白,嗯,读者自己领悟吧。总之,TREX-2就是跟各种转录密切相关。它对mRNA的核外输也是通过NXF1,这个过程主要是由GANP来完成的。但更多的细节依然不那么清楚。 还有第四种方式和更多方式。如果细胞处于压力应激状态(跟那些啥工作上学习上的压力要区别开来),mRNA甚至可能直接由NXF1送出细胞核而无需其他蛋白质,这样匆忙之下可能导致合成更多错误蛋白质,严重的结果可能是细胞最后被“忙死”。两种富丝氨酸/精氨酸剪接因子SRSF3和SRSF7能够将NXF1招募到mRNA的3’端的不翻译区域,而那里有着mRNA的多聚腺苷酸的尾巴。SRSF3能与RNA m6A阅读器(reader)蛋白YTHDC1(YTH domain-containing protein 1)结合,换言之YTHDC1似乎可以促进压力应激条件下mRNA直接外输。 其他的蛋白,包括UAP56互作因子(UAP56-interacting factor, Uif)、SR蛋白、eIF4E等等之类,都被发现参与了对mRNA出核转运的调控或者作为招募NXF1-p15的转接因子。Uif也是一种转接因子,它能借助促染色质转录复合物(Facilitates Chromatin Tranion, FACT)实现与mRNA的结合,也能与Aly协同作用;SR蛋白除了参与剪接和NMD的过程之外,对没有内含子的基因的mRNA的出核似乎也非常重要。三种SR蛋白家族的成员——SRp20、9G8和SF2被证明能充当NXF1的转接蛋白,它们的分子中一个叫RS的区域在低磷酸化的时候具有这种功能。组蛋白的基因、原癌基因JUN、G蛋白偶联受体(GPCR,多达上百种)、干扰素(INF,多达几十种)和热休克蛋白(Hsp)的基因都属于没有内含子的基因。而它们的mRNA的编码区似乎存在一些能与SR蛋白或者Aly结合的特殊序列。对于组蛋白来说,它的mRNA中存在能与SR蛋白结合的元件。且它能形成茎环结构,茎环结构的长度和这个结构相应的结合蛋白SLBP都参与了组蛋白mRNA的出核运输。 其他的无内含子基因mRNA,例如HspB-3、IFN-α1和IFN-β1的mRNA中存在一种被称为胞质聚集原件(cytoplasmic accumulation element, CAR)的特殊序列,而这个元件可以招募TREX,(也许)以及其他某些蛋白质,例如Prp19。(它是一个用于剪接pre-mRNA和修复DNA的蛋白质,招募Prp19有什么作用并不为所知,没准是招募TREX的能力带来的额外结果。)一些没有内含子的分泌蛋白基因的mRNA中还存在其他的元件(例如,ALREX元件(ALREX全称是替代性mRNA核外输(alternative mRNA nuclear export)),它们也能招募TREX来送它出细胞核。哪怕是一些断裂基因的外显子中也含有Aly(TREX)的特异性结合序列,所以说,顺式元件在TREX的募集过程中显得并不稀罕,相反还是常规操作。  Aly的RNA结合结构域。PDB号:1NO8 Aly的RNA结合结构域。PDB号:1NO8eIF4E则是在帽子结构的基础上发挥作用。在当初mRNA被加上帽子时, eIF4E也会与帽子结合。虽然它的名字显示eIF4E这个蛋白的本职是(结合核糖体,然后)启动mRNA的翻译过程,但它似乎可以在LRPPRC(Leucine-rich PPR motif-containing)蛋白的协助下促进含有名为eIF4E敏感元件(4E-SE)的mRNA出核,而且是借助CRM1(与TREX所使用的转接因子不同,见上文)而非NXF1。另外,研究还表明,CPSF的组成部分之一——CPSF6能与NXF1结合,这样可以促进mRNA出细胞核。 有意思的是,lncRNA和mRNA的3’端加工是通过不同的蛋白质来进行的,这似乎是导致大部分lncRNA留在细胞核内和mRNA却被运出细胞核的主要原因之一。 想起之前提到细胞如何区分snRNA和mRNA的事了么? 细胞选择哪种路径来输出mRNA似乎具有一定的选择性和竞争性。例如: CRM1的路径通常被用来运输一系列翻译产物与细胞增殖、细胞生存和转移(metastasis)和侵入有关的mRNA,这样一来,CRM1完全可能成为癌细胞非常喜欢的蛋白质; TREX-2能通过GANP促进有关RNA修饰、剪接、信使核糖核蛋白体(mRNP)和核糖体生成的mRNA的核外输; TREX复合体中的Thoc5和Thoc2似乎能影响有关造血系统发育和干细胞多能性的mRNA的外输; RNA m6A编写器(writer)复合体(“编写器”的意思就是催化腺嘌呤加上甲基)能与TREX结合(但不确定是通过哪个亚单位),促进交给TREX负责的mRNA的核外输转运。而这个编写器复合体是由ZC3H13(Zinc finger CCCH domain-containing protein 13)、VIRMA(Protein virilizer homolog/KIAA1429)、RBM15、METTL3(Methyltransferase-like protein 3)、METTL14和WTAP(WT1-associated protein)组成的大型复合蛋白。RBM15和与之相似的另外一个蛋白RBM15B都能与NXF1结合; Aly在控制有关基因组完整性(基因组复制与修复)和mRNA m5C修饰蛋白的mRNA出核方面起作用。mRNA的m5C修饰可以由Aly特异性识别。它是由RNA甲基转移酶NSUN2负责催化加上去的,NSUN2因此也能影响Aly的功能。(细胞只对一部分mRNA添加这个修饰,所以TREX由此似乎更偏好被招募到这类mRNA上并帮助它们出核。)此外,多磷酸肌醇多激酶(IPMK)与它的催化产物磷脂酰肌醇-3,4,5-三磷酸(PIP3)能够调节Aly的外输活性,这是2013年一项来自剑桥大学和黄集团/医学研究局癌病研究中心和医学研究委员会分子生物学实验室的研究人员的研究结果:他们发现一个涉及DNA同源重组修复的蛋白质——Rad51的mRNA上存在一段特殊的序列,而Aly可以识别这段序列并促进它向核外转运,但前提必须是IPMK或者PIP3在场。 …… 病毒“为了”入侵人体细胞并顺利地复制和增殖,进化出了很多利用细胞内部蛋白质的能力,这其中也包括出核转运。例如艾滋病病毒HIV的Rev蛋白能够一面“牵”住自己的RNA,一面与CRM1结合,然后将自己的遗传物质送出细胞核。出细胞核之后,也许拿去翻译,制造更多自己的蛋白质,也许直接装配新病毒;乙肝病毒的RNA中的一段特殊序列SEP1能结合锌指蛋白ZC3H18,从而招募TREX来帮它出核;流感病毒A的NS1蛋白能与CPSF的一个组成部分结合,抑制mRNA的尾巴形成,导致它无法出细胞核。(这一操作似乎为自己的RNA腾出了更多的核孔,从而有利于自己RNA的出核。因为NS1蛋白似乎不会阻碍病毒自己的RNA出核。) 总结 以上这些信息提示我们,细胞不但会通过决定DNA是否转录或者DNA转录的频率来调控基因表达,还会通过其他方式来调控基因表达,例如mRNA的转运,而且这是一个更加难以理解的过程。mRNA出核转运的过程同转录、剪接、转录后修饰和翻译都紧密地联系起来,这些过程并非相互孤立,而是具有高度连续性、高度动态和高度复杂性的过程——例如,转录一开始,大约第25个碱基时,RNA就被加帽;转录还没结束,剪接体蛋白和外输蛋白的招募就会开始……从头到尾,mRNA上都结合着一大堆蛋白质,而不是大家可能会想象成的那样,是一条光溜溜的RNA。这其中的大量分子层面的细节我们至今都未能弄明白,更不要谈亚分子层面的,例如某某蛋白是如何催化反应,或者这些蛋白质的构象是如何变化等等。mRNA这样复杂的运输方式也可能还有其他功能,例如监测mRNA的转录和结构是否正常,等等。其次,到底是什么样特征,能让细胞区分mRNA和其他的RNA,以及如何具有不同功能和结构的mRNA,并采用对应的运输机器运输它们出核呢?以前的研究结果告诉我们,对RNA的某些化学修饰(例如m5C、m6A)、RNA上的某些特殊序列可能成为这样的特征,但这些是仅有的能让细胞区分不同RNA的特征吗?即便不说那些特殊序列和特殊结构,细胞对RNA的化学修饰也可是多达上百种之多!不得不说,我们至今还远在尝试研究和理解这些化学修饰的路上,将它们纳入我们的数据库中,将是一项极为庞大的工程。核酸修饰及其与蛋白质的相互作用会不会成为下一个研究热门的引爆点呢?让我们拭目以待吧。 对RNA质量监控与出核的研究也为我们提供了一个鲜明的案例,它表明表型并非唯一能选择遗传物质的因素,细胞内也有看不见的机制在对有效的mRNA序列和结构产生选择作用。细胞产生这么复杂的运输机制,大概主要是对mRNA质量监控的需要所驱动的,细胞难以容忍那些结构异常的mRNA拿去翻译出完全错误的蛋白质,这提示我们在更多的情况下,翻译出错误的蛋白甚至比不生产这个蛋白害处更大。当两个等位基因中的一个发生突变而产生异常的mRNA时,这些转录本将很难离开细胞核并转移到核糖体进行翻译,这样细胞就可以保证只让野生型的转录产物出核并翻译。说到这里是不是有点熟悉?这就恰恰是等价于“野生型等位基因为显性,而突变基因为隐性”这个现象了。控制显隐性的机制说到底是非常多样的,例如,日本的科学家曾发现对于某些基因来说,显性基因的转录产物似乎会引发隐性基因被甲基化,导致后者的表达被抑制。反过来想,这会不会是细胞中的又一种我们没有完全弄明白其细节的DNA(RNA)质量监控机制呢? 我们同时也要注意到,并不是所有突变基因都会被复杂的出核机制和NMD扼杀在翻译前的历程中,质量监控机制的能力是有限的,保持这种能力的有限性也有一定的必要性。就以剪接这一点为例,按照研究人员根据来自深度测序技术所得出的结果的估计,有多达95%的断裂基因(多外显子基因)都会经历可变剪接。mRNA的不同剪接形式所翻译产生的蛋白质完全可能发挥不同的功能,甚至相反的功能。难道产生不同的剪接形式就非要将其扼杀在摇篮不可吗?很难说有这个必要。mRNA在翻译前所经历的过程让我们很容易推测一些不涉及基因改变的突变可能会在这个过程中发生——而且难以完全排除它们的可遗传性。这正是另外一个需要注意的地方——不同的细胞可能偏好性地利用不同的转接因子运送它们的mRNA出细胞核,而这个特征很可能成为下一个细胞分型和病理分型的依据。 说到疾病——出核既然是一个严格的基因表达调控过程,那就必然与疾病具有直接而紧密的联系。例如,在大约30%的癌症中都能检测到eIF4E水平异常上升,而eIF4E似乎同有关生长发育的基因的mRNA的外输有一定关联;亮氨酸拉链蛋白4(leucine zipper protein 4, Luzp4)(也是一个转接蛋白,且能与UAP56结合)的浓度被发现在包括恶性黑素瘤在内的诸多癌症中增加了。Luzp4是什么来头呢?它是一种癌症睾丸抗原(caner testis antigen, CTA),其基因位于X染色体上,平时只在睾丸具有一定表达水平。但恶性黑素瘤细胞非常偏好利用这个蛋白质来完成自己细胞核内mRNA的外输。此外,Thoc1和Aly的调节也被发现在各种癌细胞中出现紊乱。TREX复合体对mRNA的正确折叠也很重要,TREX突变体似乎比正常细胞更容易出现R-环结构,那是一种RNA-DNA杂交链之间形成的异常的环状结构,会导致基因组处于不稳定状态。TREX-2也被证明与乳腺癌易感基因BRCA2存在协同作用,这种作用对基因组稳定性的维持同样重要。在其他疾病中也发现出核机制异常,或者某些其他原因导致出核异常的踪迹。如I型成骨不全症(Osteogenesis imperfecta)中,由于胶原蛋白基因COL1A1位于剪接位点的一个突变,其26号内含子被保留在mRNA中,而这直接导致这段mRNA无法出细胞核从而被大量滞留在细胞核内。(而且据推测,由于这个突变导致终止密码子提前出现,即便那一小部分异常的mRNA成功出核了,也会因为NMD机制而被降解。)在I型致死性先天性挛缩综合征(Lethal congenital contracture syndrome)和致死性关节病与前角细胞病(lethal arthrogryposis with anterior horn cell disease)的患者的细胞中,研究者检测到Gle1的突变。这个突变导致GLE1基因的3号内含子中的一个碱基被替换,导致错误剪接事件(没错,虽然内含子一般并不翻译成蛋白质——且不考虑有的时候内含子会被可变剪接机制保留下来——但它并不是一无是处),导致9个额外的碱基出现在mRNA中,从而翻译出来的蛋白质中多出来3个氨基酸,不过,这个突变引发疾病的机制暂时不清楚。 总之,对RNA出核这个过程——尤其是它与核内众多蛋白质和分子通路的联系的研究(基于我们对基因表达及其调控的进行深入理解的大背景),很可能将在未来成为一个热点问题,我们在这个过程方面的研究所投入的不懈努力将最终成为新的医学与生命之光。 Ref: (说明:此处所给的参文一般性地包含了本文的所有信息源(如果全部基于原始文献列出来,可能会有超过500篇参文,会顶破字数限制),有一些内容可能通过下列中的综述间接引用,另引用格式有一些不整齐,还请读者见谅。) 迟斌凯, 王可, 范静,等. mRNA的出核转运[J]. 生命的化学, 2014, 034(004):442-448. 迟斌凯, 朱长兰, 王庆亮,等. mRNA出核转运及其偶联网络[J]. 生命科学, 2010, 22(007):703-709. Min S , Heng Z , Xudong W , et al. ALYREF mainly binds to the 5 ' and the 3 ' regions of the mRNA in vivo[J]. Nuclc Acids Research, 2017(16):9640-9653. de Anda-Jáuregui G, Velázquez-Caldelas TE, Espinal-Enríquez J and Hernández-Lemus E (2016) Transcriptional Network Architecture of Breast Cancer Molecular Subtypes. Front. Physiol. 7:568. doi: 10.3389/fphys.2016.00568 Viphakone N , Sudbery I , Griffith L , et al. Co-transcriptional Loading of RNA Export Factors Shapes the Human Transcriptome[J]. Molecular cell, 2019, 75:1-14. Piruat, J. I . A novel yeast gene, THO2, is involved in RNA pol II transcription and provides new evidence for transcriptional elongation-associated recombination.[J]. Embo Journal, 2014, 17(16):4859-4872. Tange, T. Ø., Shibuya, T., Jurica, M. S., & Moore, M. J. (2005). Biochemical analysis of the EJC reveals two new factors and a stable tetrameric protein core.RNA (New York, N.Y.),11(12), 1869–1883. https://doi.org/10.1261/rna.2155905 Saulière, J., Murigneux, V., Wang, Z.et al.CLIP-seq of eIF4AIII reveals transcriptome-wide mapping of the human exon junction complex.Nat Struct Mol Biol19,1124–1131 (2012). Choudhury S R , Singh A K , Mcleod T , et al. Exon junction complex proteins bind nascent transcripts independently of pre-mRNA splicing in Drosophila melanogaster[J]. eLife,5,(2016-11-21), 2016, 5. Köhler, A., Hurt, E. Exporting RNA from the nucleus to the cytoplasm.Nat Rev Mol Cell Biol8,761–773 (2007). https://doi.org/10.1038/nrm2255 Nicolas V , Cumberbatch M G , Livingstone M J , et al. Luzp4 defines a new mRNA export pathway in cancer cells[J]. Nuclc Acids Research, 2015, 43(1). Topisirovic I, Siddiqui N, Lapointe VL, Trost M, Thibault P, Bangeranye C, Piñol-Roma S, Borden KL. Molecular dissection of the eukaryotic initiation factor 4E (eIF4E) export-competent RNP. EMBO J. 2009 Apr 22;28(8):1087-98. doi: 10.1038/emboj.2009.53. Epub 2009 Mar 5. PMID: 19262567; PMCID: PMC2683702. Zhu Y, Wang X, Forouzmand E, Jeong J, Qiao F, Sowd GA, Engelman AN, Xie X, Hertel KJ, Shi Y. Molecular Mechanisms for CFIm-Mediated Regulation of mRNA Alternative Polyadenylation. Mol Cell. 2018 Jan 4;69(1):62-74.e4. doi: 10.1016/j.molcel.2017.11.031. Epub 2017 Dec 21. PMID: 29276085; PMCID: PMC5756121. Core L, Adelman K. Promoter-proximal pausing of RNA polymerase II: a nexus of gene regulation. Genes Dev. 2019 Aug 1;33(15-16):960-982. doi: 10.1101/gad.325142.119. Epub 2019 May 23. PMID: 31123063; PMCID: PMC6672056. Masuda S, Das R, Cheng H, Hurt E, Dorman N, Reed R. Recruitment of the human TREX complex to mRNA during splicing. Genes Dev. 2005 Jul 1;19(13):1512-7. doi: 10.1101/gad.1302205. PMID: 15998806; PMCID: PMC1172058. Will CL, Lührmann R. Spliceosome structure and function. Cold Spring Harb Perspect Biol. 2011 Jul 1;3(7):a003707. doi: 10.1101/cshperspect.a003707. PMID: 21441581; PMCID: PMC3119917. Huang Y, Gattoni R, Stévenin J, Steitz JA. SR splicing factors serve as adapter proteins for TAP-dependent mRNA export. Mol Cell. 2003 Mar;11(3):837-43. doi: 10.1016/s1097-2765(03)00089-3. PMID: 12667464. Lesbirel S, Wilson SA. The m6A‑methylase complex and mRNA export. Biochim Biophys Acta Gene Regul Mech. 2019 Mar;1862(3):319-328. doi: 10.1016/j.bbagrm.2018.09.008. Epub 2018 Oct 2. PMID: 30290229; PMCID: PMC6414750. Wahl MC, Will CL, Lührmann R. The spliceosome: design principles of a dynamic RNP machine. Cell. 2009 Feb 20;136(4):701-18. doi: 10.1016/j.cell.2009.02.009. PMID: 19239890. Long JC, Caceres JF. The SR protein family of splicing factors: master regulators of gene expression. Biochem J. 2009 Jan 1;417(1):15-27. doi: 10.1042/BJ20081501. PMID: 19061484. Strässer K, Masuda S, Mason P, Pfannstiel J, Oppizzi M, Rodriguez-Navarro S, Rondón AG, Aguilera A, Struhl K, Reed R, Hurt E. TREX is a conserved complex coupling transcription with messenger RNA export. Nature. 2002 May 16;417(6886):304-8. doi: 10.1038/nature746. Epub 2002 Apr 28. PMID: 11979277. Katahira J . mRNA export and the TREX complex.[J]. Biochim Biophys Acta, 2012, 1819( 6):507-513. Heath CG, Viphakone N, Wilson SA. The role of TREX in gene expression and disease. Biochem J. 2016 Oct 1;473(19):2911-35. doi: 10.1042/BCJ20160010. PMID: 27679854; PMCID: PMC5095910. 迟斌凯, 王可, 范静, et al. mRNA的出核转运[J]. 生命的化学, 2014, 034(004):442-448. 迟斌凯, 朱长兰, 王庆亮, et al. mRNA出核转运及其偶联网络[J]. 生命科学, 2010, 22(007):703-709. Hurt J A , Silver P A . mRNA nuclear export and human disease[J]. Disease Models and Mechanisms, 2008, 1(2-3):103-108. Durairaj G , Garg P , Bhaumik S R . Nuclear export of mRNA and its regulation by ubiquitylation[J]. Rna Biology, 2009, 6(5):531-535. Rodriguez M S , Dargemont C , Stutz F . Nuclear export of RNA.[J]. Biology of the Cell, 2004, 96(8):639-655. Williams T , Ngo L H , Wickramasinghe V O . Nuclear export of RNA: Different sizes, shapes and functions[J]. Seminars in Cell & Developmental Biology, 2017:S1084952117300599. 王黎芳, 杨克恭. 哺乳动物EJC的研究进展[J]. 国外医学(分子生物学分册), 2002. 陈宇晟, 杨莹. RNA修饰类型及调控蛋白[J]. 生命科学, 2018, 030(004):391-406. |
【本文地址】